质子数等于什么又等于什么( 原子结构与元素周期表)
2024-09-19 09:01:05 家电
第1课时 原子结构 元素周期表
学习目标
1.从微观角度认识原子的构成,了解原子核外电子排布规律,能画出核电荷数为 1~20 号元 素的原子结构示意图,能根据原子的结构特征确定元素。
2.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结 构之间的相互推导,提升微观探析能力。
3.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。
知识导学
知识点一、原子结构
1.原子的构成

2.质量数
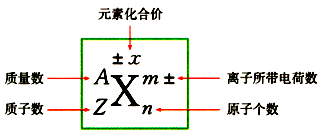
(1)概念:将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数,常用A表示。
(2)构成原子的粒子间的两个关系
①质量数(A)=质子数(Z)+中子数(N) ②质子数=核电荷数=核外电子数
3.粒子符号周围数字的含义
【例1】联合国宣布2019年为“国际化学元素周期表年”,我国的刘庄教授为汞元素的代言人。下列关于的说法中不正确的是( )
A.质子数为80 B.中子数为118
C.质量数为278 D.核外电子数为80
【例2】在RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数为_________
【例3】核外电子层结构相同的一组微粒是( )
A.Mg2+、Al3+、Cl-、Ne B.Na+、F-、S2-、Ar
C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、S2-
【例4】判断正误
(1)H+是一种没有中子和电子的粒子。( )
(2)质子数和中子数决定原子的质量。( )
(3)20 g H218O中含有的中子数目为10NA。( )
(4)H3O+和OH-具有相同的质子数和电子数。( )
(5)核外电子排布相同的两种粒子的化学性质相同。( )
【补充】人类认识原子的历史
(1)1803年道尔顿模型:原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
(2)1904年汤姆孙原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
(3)1911年卢瑟福原子模型:在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
(4)1913年玻尔原子模型电子:在原子核外空间的一定轨道上绕核做高速圆周运动。
(5)1926~1935年电子云模型:现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
知识点二、原子核外电子的排布
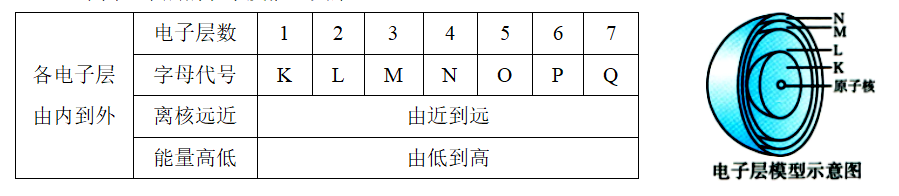
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层。这种电子层模型也被称为洋葱式结构。
(2)不同电子层的表示及能量关系
2.核外电子排布规律
(1)能量规律:核外电子优先排在能量较低的电子层,由内向外。
(2)数量规律
①各电子层最多容纳2n2个电子
②最外层电子数不超过8个电子(K为最外层时不超过2个)
③次外层电子数不超过8个电子(K为次外层时不超过2个)
④倒数第三层电子数不超过18个电子
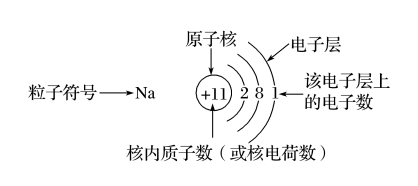
(3)原子结构示意图
以钠原子为例:
【例5】判断正误
(1)在多电子原子里,电子的能量不完全相同( )
(2)能量高的电子在离核近的区域内运动( )
(3)M层为最外层时,最多容纳18个电子( )
(4)原子的次外层电子数都是8( )
【例6】不符合原子核外电子排布基本规律的是( )
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
【例7】已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为( )
A.A(m(A-N)) mol B.A(m(A-N+2)) mol
C.A(m(A-N-2)) mol D.A(m(A+N-2)) mol
知识点三、元素周期表
1.元素周期表的发展历程

2.元素周期表的编排原则
(1)原子序数:按照元素在周期表中的顺序给元素编的序号,原子序数=核电荷数=质子数=核外电子数。
(2)横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
(3)纵列原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
3.元素周期表的结构
(1)周期

(2)族
个数 | 元素周期表中有18个纵列,共有16个族 | |
特点 | 主族元素的族序数=最外层电子数 | |
分类 | 主族 | 共有7个,包括第ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA族 |
副族 | 共有7个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族 | |
Ⅷ族 | 包括第8、9、10三个纵列 | |
0族 | 占据元素周期表的第18纵列,最外层电子数为8(He为2) | |
(3)常见族的别称
族 | 别名 |
第ⅠA族(除氢外) | 碱金属元素 |
第ⅦA族 | 卤族元素 |
0族 | 稀有气体元素 |
4.元素周期表方格中的符号的意义
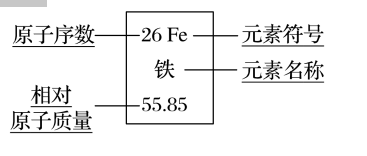
【例8】判断正误
(1)一个横行即是一个周期,一个纵列即是一个族( )
(2)每一周期都是碱金属元素开始,稀有气体元素结束( )
(3)同周期中元素电子层数一定相同( )
(4)同族元素的最外层电子数一定等于族序数( )
(5)0族元素的最外层电子数均为8( )
(6)元素周期表已发展成一个稳定的形式,它不可能再有新的变化了( )
【例9】下列关于元素周期表的叙述正确的是( )
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
【例10】假设x是第ⅡB族中某元素的原子序数,那么原子序数为x+1的元素位于( )
A.第ⅠB族 B.第ⅢB族 C.第ⅢA族 D.第ⅡA族
【例11】下列元素中,不属于主族元素的是( )
A.H B.He C.N D.Cl
猜你喜欢

今日辟谣(2025年9月15日)

Ciiq保险柜用户售后服务中心实时反馈-今-日-更-新(Ciiq保险柜险柜密码怎么设置密码)

美的保险柜24小时人工售后服务为客户解决常见故障分析与处理(美的保险柜机械保险柜密码忘了怎么办)

卡植欧保险柜售后服务热线及保养指南(卡植欧保险柜保险柜打不开怎么弄)

沸福保险柜用户售后服务中心实时反馈-今-日-汇-总(沸福保险柜保险柜怎么打开)

龙觇保险柜售后服务24小时服务热线-全国400服务号码实时反馈-今-日-汇-总(龙觇保险柜电子保险柜打不开怎么办)
今日辟谣(2025年9月15日)

Ciiq保险柜用户售后服务中心实时反馈-今-日-更-新(Ciiq保险柜险柜密码怎么设置密码)

美的保险柜24小时人工售后服务为客户解决常见故障分析与处理(美的保险柜机械保险柜密码忘了怎么办)

卡植欧保险柜售后服务热线及保养指南(卡植欧保险柜保险柜打不开怎么弄)

沸福保险柜用户售后服务中心实时反馈-今-日-汇-总(沸福保险柜保险柜怎么打开)

龙觇保险柜售后服务24小时服务热线-全国400服务号码实时反馈-今-日-汇-总(龙觇保险柜电子保险柜打不开怎么办)

丛林狐保险柜售后服务号码及其服务网点介绍实时反馈全+境+到+达(丛林狐保险柜迷你世界保险柜怎么用)

宝宸侠保险柜全国各市售后服务热线号码实时反馈-今-日-更-新(宝宸侠保险柜保险柜没电池怎么打开)

悦倪保险柜售后服务维修号码实时反馈全+境+到+达(悦倪保险柜保险柜怎么换电池图示)

耐辉顿保险柜全国统一服务热线-全国24小时服务中心实时反馈-今-日-资-讯(耐辉顿保险柜保险柜没电了怎么开锁)